2023-10-23 15:40:40
蛋白质组学之蛋白质翻译后修饰
蛋白质组学是一门研究生物体内全部蛋白质组成和功能的学科,它在当前组学研究领域扮演着重要的角色。蛋白质是细胞内的主要功能分子,是细胞代谢、信号传递和细胞结构的关键组成部分。
蛋白翻译后修饰(Post-translational modification, PTM)可以改变蛋白质的物理和化学性质,进而对其空间构象、活性状态、亚细胞定位、折叠稳定性以及蛋白质与其他蛋白质之间的相互作用产生影响。越来越多的受到青睐和关注。蛋白质的翻译后修饰种类较多,如:磷酸化、糖基化、乙酰化、泛素化等等,不同修饰可能对于蛋白的有不同的作用,今天我们来对蛋白质组学中的几个经典的翻译后修饰进行介绍。
一、磷酸化
磷酸化(英语:Phosphorylation)或称磷酸化作用,是指在蛋白质或其他类型分子上,加入一个磷酸(PO32-)基团,也可定义成“将一个磷酸基团导入一个有机分子”。此作用在生物化学中占有重要地位,我们常常所说的信号通路很大部分是基于可逆磷酸化的信号传递来形成的通路。
蛋白质磷酸化可以发生在多种类型的氨基酸上,其中丝氨酸磷酸化最常见,其次是苏氨酸。相比之下,酪氨酸的磷酸化较少发生,但由于经过磷酸化的酪氨酸较容易通过抗体纯化,因此我们对酪氨酸的磷酸化位置也有较为广泛的了解。
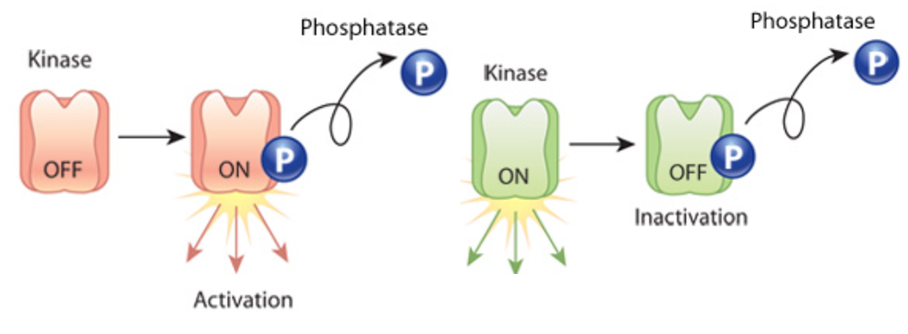
图1 蛋白磷酸化改变蛋白活性
二、糖基化
蛋白糖基化修饰是生物化学中的一个重要概念,指的是蛋白质分子上发生的糖类分子与特定氨基酸残基的共价结合。这种修饰方式在细胞内广泛存在,参与了多种生物学过程的调控。包括蛋白质稳定性、信号传导、细胞识别和黏附、免疫调节等。研究蛋白糖基化修饰对于理解生物体的正常生理功能和疾病发展具有重要意义。
糖基化修饰相比磷酸化修饰更为复杂,通常分为N-linked glycosylation和O-linked glycosylation的修饰方式,通过糖基转移酶催化结合。N糖基化修饰发生在蛋白质的Asn(天冬酰胺)位点上,糖类分子与天冬酸的羟基发生连接,并有相应的5糖核心特性,目前的报道和研究更多一些;而O糖基化修饰发生在蛋白质的Ser(丝氨酸)、Thr(苏氨酸)和Tyr(酪氨酸)位点上,糖类分子与这些位点的羟基发生连接,其相对形式更为多样和复杂。这两种修饰方式在生物体内广泛存在且具有不同的生物学功能,其不同的修饰位点和修饰的糖链结构、糖型组成均可能对蛋白质的特性造成影响。
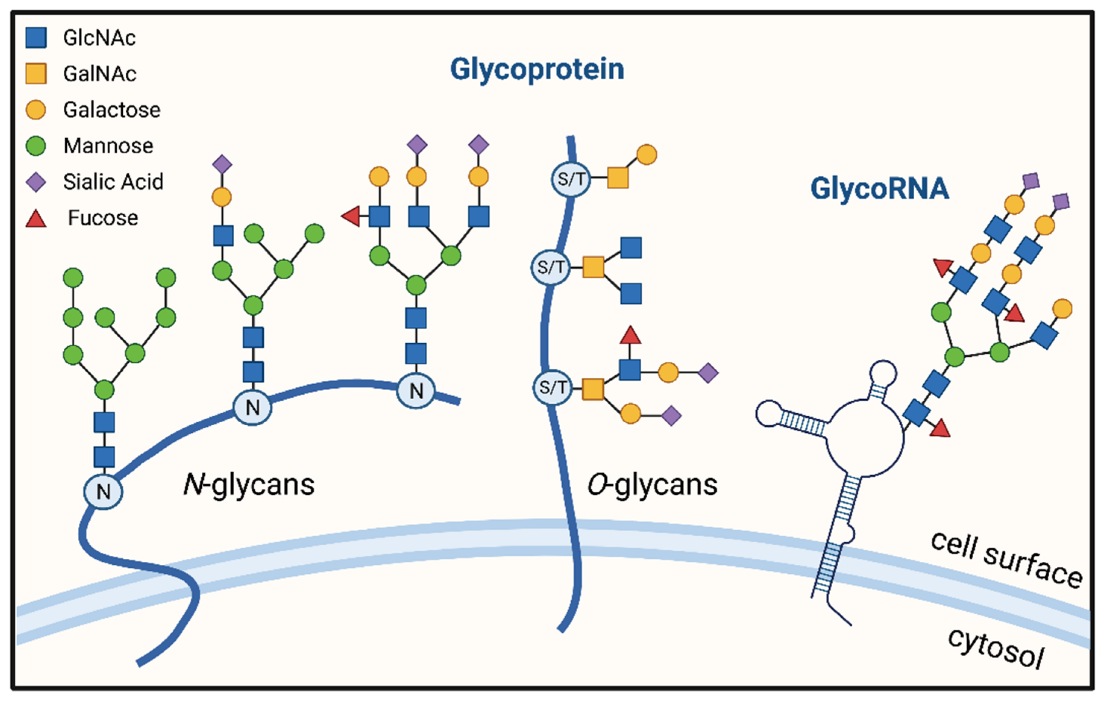
图2 糖基化示意图
三、乙酰化
蛋白质通常在N端的赖氨酸残基上发生乙酰化,该反应依赖于乙酰辅酶 A作为乙酰基供体。在组蛋白乙酰化和脱乙酰化中,作为基因调控的一部分,组蛋白在 N 末端尾部的赖氨酸残基上被乙酰化和脱乙酰化。通常,这些反应由具有组蛋白乙酰转移酶(HAT) 或组蛋白脱乙酰酶(HDAC) 活性的酶催化,组蛋白乙酰化是为一种表观遗传修饰,乙酰基化会消除组蛋白赖氨酸所带的正电荷,使其与DNA(带负电)的结合力降低,因此可将原本缠绕较紧密的染色体结构(异染色质)转成较疏松的型态(真染色质),有利于转录的进行而提升基因表达;组蛋白脱乙酰化的功能则与之相反,可使染色体结构变得更紧密而降低基因表现。
当然除了组蛋白乙酰化,其它很多蛋白均存在乙酰化修饰,进而影响蛋白的功能特性等。

图3乙酰化示意图
四、泛素化
泛素化修饰中的泛素本身就是一种较小的蛋白质,人类中主要由UBB、UBC、UBA52和RPS27A这个基因编码,将泛素添加到底物蛋白上称为泛素化。泛素化以多种方式影响蛋白质:它可以标记蛋白质进而通过蛋白酶体降解,改变蛋白质的细胞位置,影响它们的活性,并促进或阻止蛋白质相互作用等;
泛素化修饰一般发生在蛋白质的赖氨酸、半胱氨酸、丝氨酸、苏氨酸或N末端上,一个位点上发生的泛素修饰可以是单泛素修饰,也可以是多聚泛素化修饰(多聚泛素化即泛素分子在偶联到特定的蛋白氨基酸后,其它泛素分子可以和现有泛素分子的赖氨酸和甲硫氨酸再进行连接,形成多个泛素的叠加),根据其泛素分子的叠加方式位置,多聚泛素化又分为K11、K6、K48、K29 、K63或 M1等。目前发现只有特定赖氨酸上的多聚泛素化(主要是 K48 和 K29 )与蛋白酶体的降解(有关,而其他多泛素化(例如 K63、K11、K6 和 M1 上)和单泛素化可能调节内吞运输、炎症、翻译和DNA修复等过程.
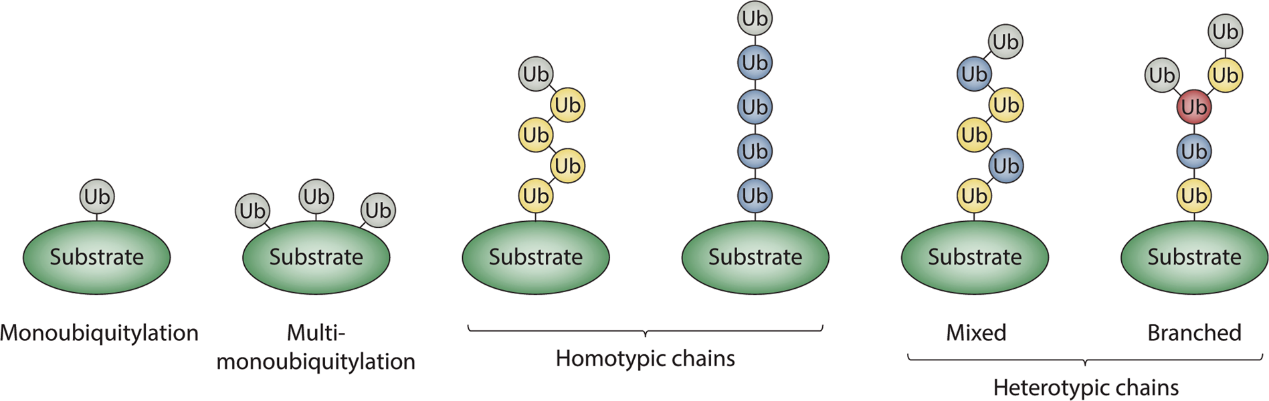
图4 泛素化示意图
以上就是对蛋白质组学中四个经典的翻译后修饰的简单介绍。
推荐新闻
-
发布时间 | 2024-08-06 13:47:51
德尔塔生物提供质粒及细胞系构建定制服务
-
发布时间 | 2024-07-03 10:24:17
水凝胶涂覆的MOF纳米粒子用作刺激响应的可控药物释放
-
发布时间 | 2024-07-03 10:20:24
Fe@γ-Fe2O3@H-TiO2的多面应用——从光催化到多模态成像介导的癌症光热治疗
-
发布时间 | 2024-06-06 17:40:56
生物功能电纺纳米材料——从拓扑结构设计到生物应用
-
发布时间 | 2024-05-22 15:01:40
GelMA气凝胶作为新型的电子皮肤材料
-
发布时间 | 2024-05-22 14:59:05
PDMS改性硅气凝胶PDMS修饰的二氧化硅气凝胶膜层
-
发布时间 | 2023-11-29 14:56:26
构建多功能化的四氧化三铁杂化纳米平台用于癌症的诊断和治疗
-
发布时间 | 2023-11-07 11:36:34
荧光标记方法有这4种,小伙伴们知道吗?
-
发布时间 | 2023-10-26 11:03:54
不同类型金属有机骨架材料合成及载雷公藤红素工艺研究
-
发布时间 | 2023-10-26 10:59:50
一种开创性的微孔有机聚合物合成模板
-
发布时间 | 2023-10-26 10:58:09
超快速半干态合成高耐久性ZIF-8膜用于丙烯/丙烷分离
-
发布时间 | 2023-10-26 10:43:37
关于PEG120-PLGA-PEG-FA文献阅读
-
发布时间 | 2023-10-26 10:41:54
ZIF-8制备原位碳掺杂氧化锌及其光催化性能研究
-
发布时间 | 2023-10-26 10:40:20
ZIF-8修饰整体柱的制备及性能研究
-
发布时间 | 2023-10-26 10:39:01
反沙漠甲虫性能的ZIF-8/PAN功能膜用于水包油乳液的高效和快速分离

