2023-11-07 11:38:56
荧光标记的选择及探针的类型
上一期我们讨论了探针和引物的设计原则,本期聚焦在荧光标记的选择和探针的类型上。探针法?染料法?这是一个问题;Taqman探针?分子信标探针?这又是一个问题。
根据荧光标记的不同,可以将qPCR实验分为探针法和染料法两大类。染料法利用能与DNA双链结合的染料来实现,如SYBR Green I。该染料在游离状态下呈现微弱的荧光,一旦与双链DNA的双螺旋小沟结合,其绿色荧光增强约1000倍(Figure 1)。因此其总的荧光强度与双链DNA含量呈正比,利用这一关系可以反映生成的PCR产物的量。SYBR GreenI的最大吸收约在497 nm,发射波长最大约在520 nm,与FAM荧光分子的光谱性质类似,因此在所有的qPCR设备中都是第一通道检测,即“FAM/SYBR Green I”通道。

Figure 1. 染料法qPCR反应示意图[1]
理论上,所有能与双链DNA结合的染料都可以用于qPCR检测,如溴化乙锭EtBr,碘化丙啶PI,吖啶橙、Cy3等。事实上,最早用于PCR反应实时监测(当时还没有形成实时荧光定量的概念)的染料是以前常用的EtBr[2]。选择用于qPCR反应的染料通常会考虑四个因素:
1.信号强,结合DNA后荧光增强的倍数越大越好;
2.生物安全性高,所以EtBr基本已淘汰使用(事实上EtBr是有理论上的潜在致癌性,但目前还没有动物实验证实);
3.检测简便,因此用红光激发的染料不常用,因为很多通道数少的qPCR设备没有配备红色LED灯;
4.经济性好,qPCR很多实验室几乎天天做,不考虑成本也不现实。
综合下来,SYBR Green I成为了比较理想的选择。当下,使用Evagreen的实验者也越来越多了,其光谱性质与SYBR Green I类似。作为一种新型的染料,其优势在于:
1. 对PCR反应的抑制程度小。高浓度SYBR Green I会强烈抑制PCR反应,因此要控制其使用浓度,一定程度上降低了DNA检测的灵敏度。
2. 与DNA结合密度高。单位长度的DNA双链上Evagreen的密度更高,为饱和型染料,消除了SYBR Green I存在的“染料重分布”的缺陷,提高检测灵敏度的同时也可用于高分辨率溶解曲线HRM。
3. 化学性质更稳定,适合长期保存。
上一期已经介绍过探针的结构,并展示了常见的Taqman探针。这种探针基本可以满足60%以上的qPCR实验,如常规的基因表达和拷贝数变异CNV实验。对于要分辨单碱基差异的SNP实验,普通Taqman探针可能就力不从心了,得采用对碱基mismatch容忍度更低的TaqmanMinor Groove Binder (MGB)探针[3](Figure 2),在quencher后加入了dihydrocyclopyrroloi- ndole tripeptide(DPI3)基团,从而提高了与靶标结合的亲和力;而且可以对靶点碱基进行化学修饰,如PeptideNucleic Acid和Locked Nucleic Acid。在后面SNP实验及应用的时候会详细介绍MGB探针和化学修饰的设计初衷。
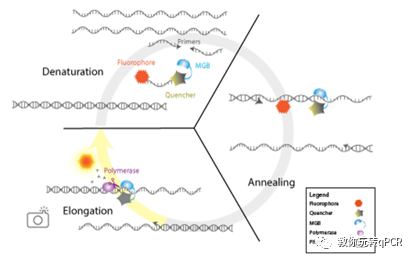
Figure 2. qPCR反应使用MGB探针的原理示意图
上一期讲过Taqman探针的设计原则,对探针的长度有比较严格的要求,dual hybridization双杂交探针则消除了这一“缺陷”。顾名思义,这种探针是由两条寡核苷酸单链组成,一条的3’端带有供体荧光分子,另一条的5’端带有受体荧光分子(Figure 3)。游离状态下荧光供体会发出荧光,但当两条单链都匹配到模板链上时,就会发生荧光共振能量转移FRET,受体荧光分子就可以发出荧光,其荧光强度与生成的产物的量成正比。双杂交探针的优势有两点:摆脱了探针长度的限制,较长的探针可以提高与模板匹配的成功率;只有上下游两条探针都正确匹配后才能检测到受体荧光分子发出的荧光,特异性有所提高。
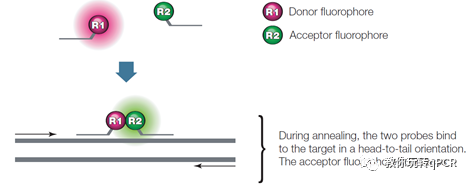
Figure3. 双杂交探针的原理示意图[1]
显然,从设计难度上来讲双杂交探针比单个的探针还是要大一些,大家还是更倾向于设计单探针,于是在两种探针之间又延伸出一种新型的单探针——molecularbeacon分子信标探针。游离状态下该探针是一种茎环结构,其环状部分的15-30个碱基可以与靶标区域相结合匹配,下端的配对区域(左右一般各5-6个碱基)则由重复的GC组成,从而将5’的荧光分子和3’的淬灭基团紧紧聚在一起,荧光发生淬灭;当退火时,分子信标探针解开环并与模板靶标杂交,这样荧光分子和淬灭基团的物理距离就变大了,荧光淬灭的前提就打破了(Figure4)。除了MGB探针,分子信标探针也非常适合用于SNP检测。与Taqman探针不同的是,分子信标探针在延伸过程中中并不会被聚合酶水解掉,而是又从模板链链上脱落下来变成了茎环结构,参与下一次的循环,因此并不是Taqman探针的那种累积信号模式。与线性的Taqman探针相比,茎环结构的分子信标探针特异性更高,但相对地,设计起来更困难一些,需要在发卡结构的稳定性上做出权衡:太过稳定会影响与模板的杂交,稳定性太差则会影响淬灭效率和本地信号。

Figure4. 分子信标探针的原理示意图[4]
除了以上的三种新型探针之外,还有尝试将引物和探针功能相结合的技术,如Amplifluor、LUX等,在设计难度上有所提高,但使用时更简便。LUX引物利用形成的发卡结构实现荧光淬灭,无需淬灭基团。这些相对较新的技术,各有其应用的侧重点和设计上的利弊,在此不多赘述,后期可能拿出一两个大家很感兴趣的技术作为专题讲解。
当做qPCR实验的时候,如何在染料法和探针法上取舍?下面的这张表格可作为总结参考,只能说两者各有利弊。事实上国内科研结构做的qPCR实验中用的最多的是染料法,大多是从成本上考虑;而临床中用到的qPCR试剂盒基本都是采用探针法,研发者大多是从反应特异性上考虑。
Table1. 染料法和探针法的区别
染料法 | Taqman探针法 | |
使用便捷 | 只需要一对引物,设计使用更简单 | 需要一对引物和一条探针,设计使用更麻烦 |
特异性 | 只能通过引物来把关,特异性相对探针法稍差;好处是可通过溶解曲线来判断特异性 | 引物和探针双重保险,特异性较好 |
实验成本 | 引物和染料的成本很低 | 探针的成本相对较高 |
反应重数 | 一个反应只能检测一个靶标基因 | 可以实现多重反应,检测多个靶标基因 |
下一期将展示引物和探针的设计实例,希望对大家的日常实验有所帮助。
推荐新闻
-
发布时间 | 2024-08-06 13:47:51
德尔塔生物提供质粒及细胞系构建定制服务
-
发布时间 | 2024-07-03 10:24:17
水凝胶涂覆的MOF纳米粒子用作刺激响应的可控药物释放
-
发布时间 | 2024-07-03 10:20:24
Fe@γ-Fe2O3@H-TiO2的多面应用——从光催化到多模态成像介导的癌症光热治疗
-
发布时间 | 2024-06-06 17:40:56
生物功能电纺纳米材料——从拓扑结构设计到生物应用
-
发布时间 | 2024-05-22 15:01:40
GelMA气凝胶作为新型的电子皮肤材料
-
发布时间 | 2024-05-22 14:59:05
PDMS改性硅气凝胶PDMS修饰的二氧化硅气凝胶膜层
-
发布时间 | 2023-11-29 14:56:26
构建多功能化的四氧化三铁杂化纳米平台用于癌症的诊断和治疗
-
发布时间 | 2023-11-07 11:36:34
荧光标记方法有这4种,小伙伴们知道吗?
-
发布时间 | 2023-10-26 11:03:54
不同类型金属有机骨架材料合成及载雷公藤红素工艺研究
-
发布时间 | 2023-10-26 10:59:50
一种开创性的微孔有机聚合物合成模板
-
发布时间 | 2023-10-26 10:58:09
超快速半干态合成高耐久性ZIF-8膜用于丙烯/丙烷分离
-
发布时间 | 2023-10-26 10:43:37
关于PEG120-PLGA-PEG-FA文献阅读
-
发布时间 | 2023-10-26 10:41:54
ZIF-8制备原位碳掺杂氧化锌及其光催化性能研究
-
发布时间 | 2023-10-26 10:40:20
ZIF-8修饰整体柱的制备及性能研究
-
发布时间 | 2023-10-26 10:39:01
反沙漠甲虫性能的ZIF-8/PAN功能膜用于水包油乳液的高效和快速分离

